某省原料藥GMP檢查要點(DOC 32頁)
某省原料藥GMP檢查要點(DOC 32頁)內容簡介
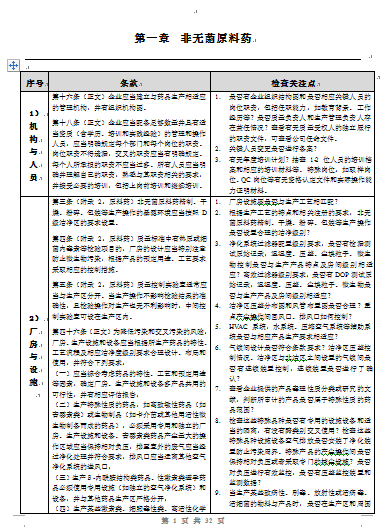
第十六條(正文)企業應當建立與藥品生產相適應的管理機構,並有組織機構圖。
第十八條(正文)企業應當配備足夠數量並具有適當資質(含學曆、培訓和實踐經驗)
的管理和操作人員,應當明確規定每個部門和每個崗位的職責。崗位職責不得遺漏,
交叉的職責應當有明確規定。每個人所承擔的職責不應當過多。所有人員應當明確並理解自己的職責,
熟悉與其職責相關的要求,並接受必要的培訓,包括上崗前培訓和繼續培訓。
第三條(附錄2:原料藥)非無菌原料藥精製、幹燥、粉碎、
包裝等生產操作的暴露環境應當按照D級潔淨區的要求設置。
第四條(附錄2:原料藥)質量標準中有熱原或細菌內毒素等檢驗項目的,
廠房的設計應當特別注意防止微生物汙染,根據產品的預定用途、工藝要求采取相應的控製措施。
第五條(附錄2:原料藥)質量控製實驗室通常應當與生產區分開。
當生產操作不影響檢驗結果的準確性,且檢驗操作對生產也無不利影響時,中間控製實驗室可設在生產區內。
第四十六條(正文)為降低汙染和交叉汙染的風險,廠房、
生產設施和設備應當根據所生產藥品的特性、
工藝流程及相應潔淨度級別要求合理設計、布局和使用,並符合下列要求:
(一)應當綜合考慮藥品的特性、工藝和預定用途等因素,確定廠房、
生產設施和設備多產品共用的可行性,並有相應評估報告;
..............................
第十八條(正文)企業應當配備足夠數量並具有適當資質(含學曆、培訓和實踐經驗)
的管理和操作人員,應當明確規定每個部門和每個崗位的職責。崗位職責不得遺漏,
交叉的職責應當有明確規定。每個人所承擔的職責不應當過多。所有人員應當明確並理解自己的職責,
熟悉與其職責相關的要求,並接受必要的培訓,包括上崗前培訓和繼續培訓。
第三條(附錄2:原料藥)非無菌原料藥精製、幹燥、粉碎、
包裝等生產操作的暴露環境應當按照D級潔淨區的要求設置。
第四條(附錄2:原料藥)質量標準中有熱原或細菌內毒素等檢驗項目的,
廠房的設計應當特別注意防止微生物汙染,根據產品的預定用途、工藝要求采取相應的控製措施。
第五條(附錄2:原料藥)質量控製實驗室通常應當與生產區分開。
當生產操作不影響檢驗結果的準確性,且檢驗操作對生產也無不利影響時,中間控製實驗室可設在生產區內。
第四十六條(正文)為降低汙染和交叉汙染的風險,廠房、
生產設施和設備應當根據所生產藥品的特性、
工藝流程及相應潔淨度級別要求合理設計、布局和使用,並符合下列要求:
(一)應當綜合考慮藥品的特性、工藝和預定用途等因素,確定廠房、
生產設施和設備多產品共用的可行性,並有相應評估報告;
..............................

用戶登陸
醫療藥品管理熱門資料
醫療藥品管理相關下載